- Dettagli
- A cura di Rocco Lombardo
- Categoria: Lezioni sui Legami chimici
- Visite: 88002
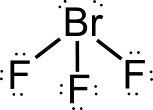
Esercizio guidato per la definizione della struttura di Lewis e della geometria molecolare secondo il modello VSEPR del diossido di carbonio, con la definizio della struttura e della geometria della CO2.
Leggi tutto: Struttura di Lewis e geometria della CO2 modello VSEPR


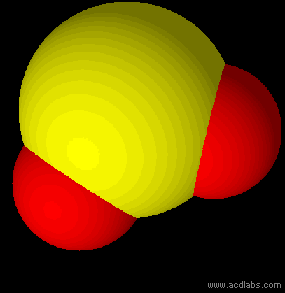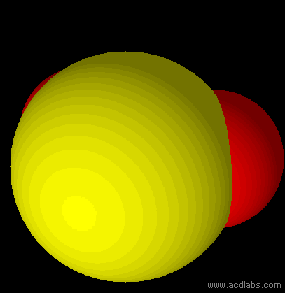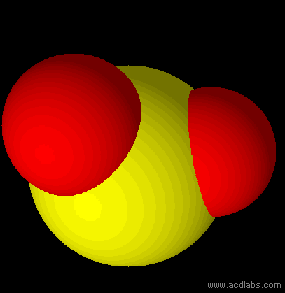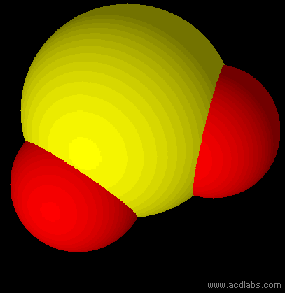 In chimica ed in biologia lo studio della forma delle molecole riveste un'enorme importanza per capire e prevedere il loro comportamento ed alcune delle loro proprietà chimiche e fisiche. Si può ricavare in modo teorico e approssimato la geometria molecolare dei composti utilizzando il modello VSEPR.
In chimica ed in biologia lo studio della forma delle molecole riveste un'enorme importanza per capire e prevedere il loro comportamento ed alcune delle loro proprietà chimiche e fisiche. Si può ricavare in modo teorico e approssimato la geometria molecolare dei composti utilizzando il modello VSEPR.