Ho scritto questa breve serie di appunti con uno scopo preciso: fornire, a chi ha poco tempo a disposizione, uno strumento agile per affrontare la risoluzione degli esercizi riguardanti il calcolo del pH di soluzioni acquose di acidi e di basi. Il tutto viene fornito sotto forma di formulario. So che qualcuno sta già torcendo il naso e so per esperienza che non si impara un argomento con la semplice applicazione di una formula, il tutto in maniera meccanica.
Quindi, per una trattazione più analitica vi consiglio di rivolgere la vostra attenzione alla lettura di un testo di chimica, sia esso di secondaria superiore o universitario. Se invece vi serve un promemoria delle cose più importanti da sapere per risolvere con rapidità gli esercizi sul pH, beh... allora siete nel posto giusto.
Il calcolo del pH
Prima di addentrarci nella materia, è opportuno fare alcune considerazioni basilari sul pH.
Bisogna ricordare che l'acqua è sempre ionizzata secondo l'equilibrio di autoprotolisi:

A 25°C vale sempre la seguente condizione:

La costante Kw viene detta prodotto ionico dell'acqua e vale (a 25°C) 1·10-14 (mol/L)2.
Il pH si definisce come:
pH = -log [H3O+]
mentre il pOH è dato dalla seguente relazione:
pOH = -log [OH-]
A 25 °C è valida anche la seguente relazione:
pH + pOH = 14
Gli acidi e le basi si dicono forti quando sono completamente ionizzati. La forza di un acido è espressa dalla sua costante di ionizzazione, Ka; maggiore è il valore numerico di Ka, più forte sarà l'acido. La forza di una base è espressa dalla sua costante di ionizzazione, Kb; maggiore è il valore numerico di Kb, più forte sarà la base.
Attenzione! Se si usa il pKa o il pKb, dove:
pKa = - log Ka
pKb = - log Kb
il valore di pKa o di pKb sarà tanto più elevato quanto più l'acido o la base sono deboli.
Si dimostra che il prodotto Ka·Kb, dove Ka è la costante di ionizzazione di un acido e Kb è la costante di ionizzazione della sua base coniugata, è uguale a Kw:
Ka·Kb = Kw a 25 °C
Da questa relazione si può notare che se un acido è forte, la sua base coniugata sarà debole e, viceversa, se un acido è debole la sua base coniugata sarà forte (proporzionalità inversa).
Acidi e basi forti
Se le concentrazioni dell'acido (Ca) o della base (Cb) sono maggiori di 10-6 M, si può considerare ininfluente l'autoprotolisi dell'acqua, dato che c'è l'effetto dello ione comune H3O+ che spinge l'equilibrio di ionizzazione dell'acqua verso sinistra. Quindi negli acidi e nelle basi monoprotiche, la concentrazione di ioni H3O+ e di ioni OH- coincide con quelle, rispettivamente, dell'acido e della base.
Possiamo scrivere:
[H3O+]tot = Ca
pH = - log [H3O+] = - log Ca
Nel caso di una base:
[OH-]tot = Cb
[H3O+] = Kw/[OH-] = Kw/Cb
Se invece Ca <10-6 M o Cb <10-6 M si deve considerare anche l'apporto di ioni H3O+ o OH- derivanti dall'acqua, per cui:
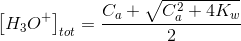
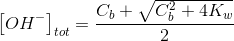
Acidi e basi deboli monoprotici
Se la Ka dell'acido è molto più elevata di Kw e se la concentrazione è maggiore di 10-6 M si può trascurare la frazione di H3O+ derivante dall'autoprotolisi dell'acqua. La concentrazione idrogenionica si calcolerà così:

Se invece il rapporto
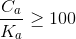
vuol dire che la ionizzazione dell'acido è scarsa per cui si potrà scrivere:

Qualora la Ka dell'acido sia inferiore a 10-8 e la concentrazione dell'acido sia uguale o inferiore a 10-6 M si deve tener conto degli ioni H3O+ provenienti dall'acqua. Useremo quindi la seguente formula:

Se, durante il calcolo, si vede che KaCa>>Kw allora si userà la relazione precedente, potendosi trascurare Kw.
Per le basi deboli vale lo stesso discorso:
per Kb>>Kw e Cb > 10-6 M

Se

allora

Se invece Kb<10-8 e Cb<10-6 M

Nel caso in cui si debba calcolare il grado di ionizzazione α di un acido debole possiamo applicare la seguente relazione:

Nel caso in cui si dovesse verificare questa condizione:

allora possiamo utilizzare questa seconda relazione:

Nel caso di una base si possono applicare le stesse relazioni e fare le stesse considerazioni.

se risulta verificato che

allora

Possiamo anche calcolare la concentrazione di ioni idronio, conoscendo α e Ca:

oppure, nel caso di una base debole, la concentrazione di ioni idrossido conoscendo α e Cb:
