- Dettagli
- A cura di Rocco Lombardo
- Categoria: Lezioni sui Legami chimici
- Visite: 145926
Per disegnare la struttura delle molecole uno dei sistemi che preferisco è il metodo di Lewis. Spesso però vedo che gli studenti hanno notevoli difficoltà, soprattutto quando si tratta di disegnare composti con elementi del terzo periodo o superiore. Questi ultimi, infatti possiedono orbitali d in riempimento e sono perciò capaci di espandere il loro guscio di valenza al di là del normale ottetto di elettroni (ottetto espanso), formando più del numero "normale" di legami che sarebbe loro consentito in base al gruppo di appartenenza. Nel trifluoruro di bromo, ad esempio, l'atomo di bromo forma tre legami covalenti piuttosto che uno solo ed ha dieci elettroni nel suo guscio esterno invece di otto.
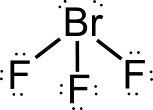
Struttura di Lewis del trifluoruro di bromo (non viene rappresentata la corretta geometria molecolare)