Le redox e il bilanciamento
Bilanciare una redox significa assegnare i corretti coefficienti ai reagenti ed ai prodotti, in cui due o più elementi vedono variare il loro numero di ossidazione. Ciò può essere conseguito in vari modi, con tecniche diverse. C'è persino chi bilancia "per tentativi", ma è chiaro che, soprattutto nelle reazioni più complesse, questa metodica risulta lunga e difficoltosa.
Qui voglio proporre un sistema che ritengo molto efficace, intuitivo e rigoroso. Viene chiamato metodo ionico-elettronico, è molto comodo per le reazioni che si svolgono in ambiente acido o basico, ma può essere utilizzato anche, con alcuni accorgimenti, per reazioni che avvengono in ambiente neutro.
Vediamo due esempi di reazione, la prima in ambiente acido, la seconda condotta in ambiente basico.
Primo esempio
Facciamo reagire il bicromato di potassio con il perossido di idrogeno, in ambiente acido per acido solforico:
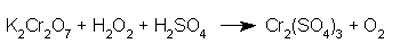
e dobbiamo bilanciarla.
Scriviamo prima di tutto, la reazione in forma ionica, assegnando i n.o. ad ogni elemento:
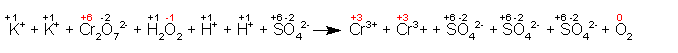
Dall'esame dei n.o. (per facilitare il compito ho evidenziato le variazioni in rosso) si vede che il cromo passa da +6 del bicromato a +3 del cromo trivalente (quindi si riduce perché il suo numero di ossidazione DIMINUISCE), mentre l'ossigeno passa da -1 del perossido a zero dell'ossigeno molecolare (quindi si ossida perché il suo numero di ossidazione AUMENTA).
A questo punto dobbiamo separare la semireazione di riduzione dalla semireazione di ossidazione, senza prendere in considerazione, per il momento, quelle specie chimiche che non sono direttamente interessate alla redox e che vengono quindi chiamati ioni spettatori.
Esprimiamo quindi le semireazioni in forma ionica:

io uso indicare le semireazioni con OX (ossidazione) per OXIDATION e con RED (riduzione) per REDUCTION.
Poi si devono bilanciare gli atomi ossidati e quelli ridotti:
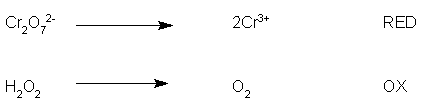
mettendo un 2 davanti allo ione Cr3+.
Poi bilanciamo l'ossigeno presente con un numero adeguato di molecole d'acqua:

ho messo, dalla parte opposta a quella dove è presente lo ione bicromato, 7 molecole d'acqua che vanno a bilanciare i 7 atomi di ossigeno presenti a sinistra della semireazione di riduzione.
Poi si bilancia l'idrogeno, mettendo tanti protoni H+ quanti ne sono necessari per bilanciare ogni semireazione:
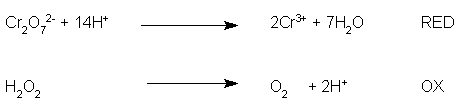
Ora è necessario bilanciare le cariche, inserendo gli elettroni in numero opportuno, ricordando che sono cariche negative:
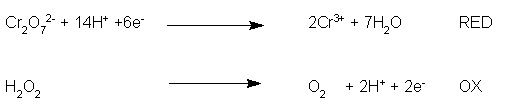
Così facendo avremo nella prima semireazione 6 cariche positive ( -2 del bicromato + 14 dei protoni -6 degli elettroni = +6) a sinistra e 6 cariche (2 per la carica 3+ del cromo trivalente = +6) a destra: cariche pareggiate. Nella seconda semireazione abbiamo zero cariche a sinistra e zero cariche (+2 dai protoni e -2 dagli elettroni: somma nulla) a destra.
Adesso è necessario bilanciare gli elettroni, tenendo presente che se la specie che si riduce necessita di n elettroni, la specie che si ossida deve cedere n elettroni, cioè lo stesso numero. Si calcola perciò il minimo comune multiplo tra il numero di elettroni implicati nelle semireazioni: tra 2 e 6 il m.c.m. è 6. Quindi moltiplicheremo la seconda semireazione per 3 (la prima andrebbe moltiplicata per 1, ma non ha senso) e si sommano le due semireazioni, membro a membro.
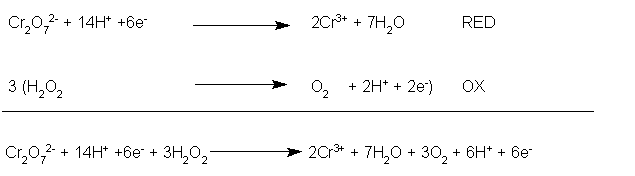
Si semplificano gli elettroni (devono elidersi completamente, altrimenti vuol dire che abbiamo sbagliato qualcosa), i protoni e le molecole d'acqua, se necessario.
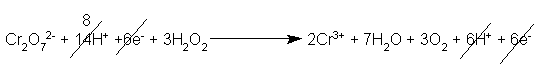
Se è sufficiente esprimere la reazione in forma ionica, il nostro compito è terminato:

oppure possiamo trasformarla in forma molecolare. In quest'ultimo caso consideriamo alcune cose: 8 H+ derivano dalla dissociazione formale di 4 molecole di acido solforico; l'anione solfato lo associamo con lo ione potassio e con il cromo trivalente, a formare i corrispondenti sali:

Controllare sempre se il bilanciamento è corretto (non si sa mai!!!).
Secondo esempio
Facciamo reagire in ambiente basico il permanganato di potassio con il biossido di azoto; la reazione forma manganato di potassio e nitrato di potassio. Qui utilizzeremo un piccolo trucco: si procede come visto sopra per l'ambiente acido ma, al termine della procedura, quando la reazione è espressa ancora in fase ionica, si aggiungerà un opportuno numero di ioni ossidrili che neutralizzeranno i protoni e produrranno acqua.
Come ho già detto la procedura è la stessa vista prima, quindi procederemo più velocemente, ora.
Si scrive la reazione in maniera semplificata:
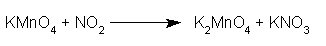
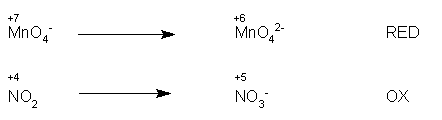
Si esprime in fase ionica, mettendo in evidenza gli elementi che mutano il loro n.o. (qui, per semplicità, ho indicato solo gli elementi che partecipano alla redox):

Si scrivono le due semireazioni:
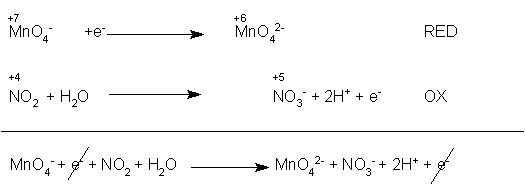
Si bilancia prima l'ossigeno (con l'acqua) e poi l'idrogeno (con i protoni H+):

Bilanciamo le cariche con gli elettroni, bilanciamo il numero degli elettroni (in questo caso non ce n'è bisogno) e sommiamo le due semireazioni, facendo le opportune semplificazioni:
A questo punto dobbiamo neutralizzare, a destra, i due ioni H+, con altrettanti ioni ossidrili OH-, in entrambi i termini della reazione, cioè sia a destra che a sinistra:

Si formerà quindi dell'acqua a sinistra (2H+ + 2OH- danno 2 molecole d'acqua), come prodotto, mentre a destra abbiamo così ottenuto l'ambiente basico necessario. Semplifichiamo, dato che è necessario, in questo caso:
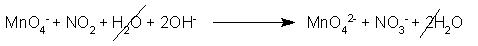
Come già visto nel primo esempio possiamo esprimere la nostra reazione, sia in forma ionica:

che in forma molecolare:
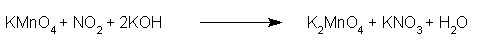
Anche in questo caso è opportuno controllare se il bilanciamento è corretto.
