I polimeri sono sostanze formate un grande numero di unità strutturali, dette monomeri, legate assieme dallo stesso tipo di legame. Queste sostanze spesso formano strutture a catena.
I polimeri sono molto diffusi in natura: l’amido, la cellulosa e il caucciù sono tutti polimeri naturali. L’uomo ha cominciato a fabbricare dei polimeri dal 1832. Oggi, l’industria dei polimeri è cresciuta molto di più di altre tipologie di produzioni. I polimeri hanno una vasta gamma di applicazioni che supera di gran lunga quella di qualsiasi altra classe di materiale disponibile per l'uomo. Le attuali applicazioni vanno dagli adesivi, i rivestimenti, le schiume e i materiali di imballaggio, fino alle fibre tessili e industriali, ai materiali compositi, ai dispositivi elettronici, biomedici e ottici, e i precursori di molte ceramiche high-tech sviluppate recentemente.
Il PVA, detto anche alcol polivinilico, ha una formula costituita da un numero elevato di unità ripetute di etenolo (alcol vinilico), [-CH2CHOH-]n. Il suo peso molecolare può essere compreso tra 25000 e 300000, e ciò dipende dalla lunghezza della catena; essa a sua volta influenza la sua viscosità.
Il borace, il tetraborato di sodio decaidrato, Na2B4O7 ·10H2O, quando viene sciolto in acqua, si idrolizza per formare una soluzione di acido borico-ioni borato con un pH di circa nove.
B4O72-(aq) + H2O(l) → HB4O7-(aq) + OH-(aq)
B4O72-(aq) + 5H2O(l) + 2H+(aq) → 4H3BO3(aq)
B(OH)3(aq) + H2O(l) → B(OH)4-(aq) + H+(aq)
Il borace è un’interessante specie chimica poiché contiene atomi di boro che hanno sia una ibridazione tetraedrica sia trigonale. L’acidità dell’acido borico si manifesta grazie alla capacità del boro di fungere da acido di Lewis, cioé accettore nei confronti di una coppia di elettroni piuttosto che per la sua capacità di donare protoni. Esso è quindi un acido monoprotico e non triprotico come ci si aspetterebbe. Quando le soluzioni di PVA e di tetraborato di sodio vengono mescolate, gli ioni borato B(OH)4-(aq) reagiscono con i gruppi ossidrile (OH) del PVA. Si verifica quindi la formazione di deboli legami trasversali tra le catene di polimero, che tendono a produrre un gel viscoso ed elastico. L’alta solubilità in acqua del PVA suggerisce la presenza di diffusi legami a idrogeno tra le sue molecole e l’acqua.
Materiali
- PVA, [-CH2CHOH-]n, idrolizzato all'87-90%, massa molecolare media 30000-70000, 4 g;
- Na2B4O7·10H2O, 4g;
- coloranti alimentari o indicatore acido base;
- acqua distillata;
- 1 becher da 250 cm3 ed 1 da 100 cm3;
- 1 beuta da 250 cm3;
- piastra termica con agitatore magnetico;
- bacchetta di vetro.
Procedimento
Il PVA solido viene miscelato in acqua per ottenere una soluzione al 4 per cento, ossia 4 g in 96 g di acqua. I migliori risultati si ottengono riscaldando l'acqua a circa 80 °C sulla piastra calda con un agitatore magnetico. Aggiungere la polvere molto delicatamente e lentamente nell’acqua distillata, mescolando continuamente per impedire la formazione di grumi. Temperature superiori ai 90° C possono provocare la decomposizione del PVA. Continuare a mescolare finché la soluzione non è limpida. A questo punto si può raffreddare. Il sodio tetraborato decaidrato dovrà essere preparato ad una concentrazione dell’otto per cento in acqua. Misurare 4 g di sodio tetraborato decaidrato e sciogliere in 46 g di acqua. In un becher mescolate 50 cm3 di PVA al 4 % con 10 cm3 di sodio tetraborato decaidrato all’otto per cento. Dopo alcuni minuti si forma il gel che può essere lavorato con la bacchetta di vetro. Ripetere con rapporti volumetrici diversi per capire come essi determinano la quantità di legami trasversali.
Video
Sicurezza
Indossare gli occhiali protettivi e il camice. Non ci sono pericoli associati al PVA. Il sodio tetraborato decaidrato è tossico solo per ingestione. Fare attenzione a mantenere le sostanze chimiche e il polimero lontano dai vestiti, perché possono produrre macchie permanenti.
Suggerimenti
I due liquidi possono essere mescolati in ogni rapporto ma è meglio iniziare con un rapporto 5:1 di PVA / sodio tetraborato decaidrato. Il colorante alimentare può essere aggiunto al PVA nel becher. Esso dovrebbe essere aggiunto prima di aggiungere il sodio tetraborato decaidrato.
Obiettivi didattici e ulteriori sviluppi
I gas e i liquidi sono classificati come fluidi perché entrambi possono scorrere e cambiare la loro forma. La legge della viscosità di Sir Isaac Newton (1642-1727) afferma che solo un cambiamento di temperatura influenza la viscosità di un fluido. Newton, tuttavia, non aveva mai visto il polimero prodotto in questo esperimento. Questo polimero, come altri fluidi, mostra un aumento del moto molecolare con l’aumento della temperatura, ma , a differenza di altri fluidi, la sua viscosità aumenta con l’aumentare della pressione. La pressione fa in modo che esso si comporti come un solido. Dal momento che questo polimero sfida le leggi dei fluidi di Newton, è considerato un liquido “non newtoniano” . Il tetraborato di sodio decaidrato serve per reticolare il PVA come si vede dall’equazione seguente:
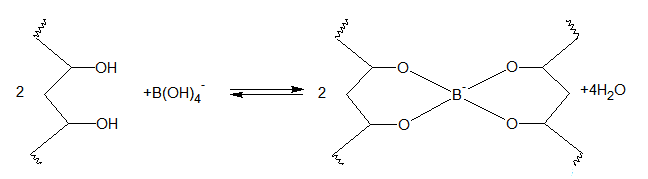
Quindi il grado di reticolazione può essere variato cambiando la concentrazione del borato, oppure “disabilitando” il borato protonandolo con un acido forte (cosa che non abbiamo fatto in questa prova). La titolazione del polimero reticolato con acido solforico permette agli studenti di esaminare la relazione tra la reticolazione, la viscosità e la formazione del gel. Questa modifica produce un interessante variante all’esperimento che permette di avvicinare gli studenti al concetto di rapporto tra struttura molecolare e proprietà delle macromolecole.
