Con questo esperimento vogliamo dimostrare la legge di Proust, detta anche legge delle proporzioni definite e costanti. Essa afferma che quando due sostanze si legano per formare un composto, le loro masse si combinano in proporzioni definite e costanti.
Esperimento per dimostrare la legge di Proust
Utilizzeremo una reazione di sintesi: facciamo reagire HCl concentrato e zinco in polvere per ottenere il composto cloruro di zinco.
Attenzione: l'acido deve essere maneggiato con cura (utilizzare guanti ed occhiali protettivi).
La reazione libera idrogeno gassoso: lavorare sotto cappa ed utilizzare una piastra termica elettrica (niente fiamme libere!!!).
Questo esperimento DEVE ESSERE ESEGUITO IN PRESENZA DELL'INSEGNANTE
Domanda principale
verificare la legge delle proporzioni definite, o legge di Proust.
Materiali usati
- spatola
- contagocce
- becher
- bilancia elettronica
- beuta
- cilindro graduato
- stufa
- piastra per riscaldare
- acido cloridrico (HCl)
- zinco (Zn)
Parole associate
- Reazioni chimiche
- reagenti
- prodotti
- effervescenza
- massa
- precipitato
Progetto
- Misuro circa 20 mL di acido cloridrico;
- peso la beuta e annoto la massa;
- metto l’acido nella beuta;
- prendo 1,2g di zinco;
- metto nella stessa beuta i due reagenti;
- aspetto che termini la violenta effervescenza poi metto la beuta sulla piastra riscaldata;
- quando vedo che tutto il liquido è evaporato, metto la beuta nella stufa per qualche minuto;
- tolgo la beuta dalla stufa e aspetto che si freddi;
- una volta fredda, peso la beuta con il sale che è rimasto e annoto la massa;
- calcolo la massa del composto salino che è rimasto in fondo alla beuta;
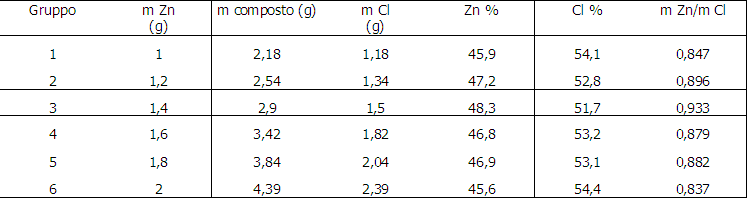
- costruisco una tabella con i dati raccolti;
- confronto i dati con quelli degli altri gruppi di lavoro.
Osservazioni
- L’acido è in quantità preponderante rispetto allo zinco, in modo da permettere la completa reazione;
- quando il metallo viene a contatto con l’acido avviene una vivace effervescenza, quindi è avvenuta una reazione chimica;
- durante l’evaporazione del liquido noto la presenza di un composto salino come precipitato;
- il composto salino è cloruro di zinco;
- è necessario il passaggio in stufa per togliere tutte le gocce di condensa formatesi sulle pareti della beuta.
DATI
HCl =20 mL
Zn =1,20 g
Massa beuta =53,44 g
Massa beuta + Massa composto =55,98 g
Per trovare la massa del composto devo sottrarre a quest’ultimo dato la massa della beuta:
m composto = (m beuta + m composto) - m beuta = 55,98 g - 53,44 g = 2,54 g
il composto (cloruro di zinco) è formato da due elementi: zinco(Zn) e cloro(Cl)
Per trovare la percentuale di composto costituita da Zn devo usare la proporzione:
mZn : m composto = x : 100
ovvero:
1,20 : 2,54 = x : 100 => 1,20 • 100/2,54 = 47,2%
Per trovare la massa del Cl devo calcolare:
m composto - m Zn = 2,54 g - 1,20 g = 1,34 g
Per trovare la percentuale di Cl adotto lo stesso procedimento usato per la percentuale di Zn, e ottengo:
Cl % = 52,8%
Faccio ora il rapporto tra la massa dello Zn e quella del Cl:
m Zn / m Cl=1,20 g / 1,54 g = 0,896
Dopo aver messo i dati in tabella osservo che i rapporti tra le masse dei due elementi, a parte piccole differenze dovute a errori sperimentali, risultano essere costanti, come le percentuali degli elementi presenti nel composto;
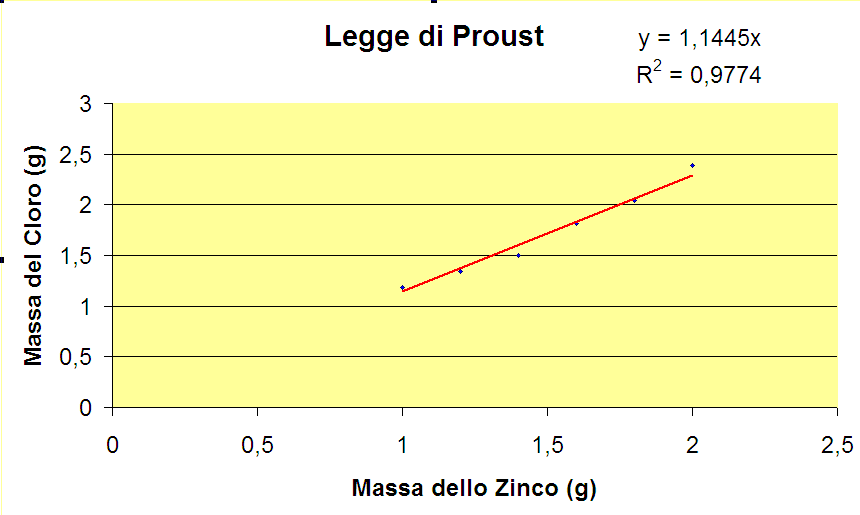
Dal grafico osservo che esiste una proporzionalità diretta.
Legge di Proust: il grafico costruito con i dati della classe
Deduzioni
In qualsiasi reazione chimica il rapporto tra la massa degli elementi che reagiscono è sempre costante e definita, qualsiasi sia la quantità e la proporzione dei due reagenti; infatti anche se nell’esperimento eseguito la quantità di acido è di molto superiore rispetto a quella dello zinco (si dice che è in eccesso) il rapporto delle masse rimane costante. Se metto una serie di dati sperimentali, ottenuti con questo esperimento, in un grafico ottengo una proporzionalità diretta.
Crediti
Prova e relazione di laboratorio svolte dagli studenti del 2° anno della sezione A scientifico tecnologico dell'ITIS V. Volterra di Ancona nell'a.s. 2003/2004