 In chimica ed in biologia lo studio della forma delle molecole riveste un'enorme importanza per capire e prevedere il loro comportamento ed alcune delle loro proprietà chimiche e fisiche. Si può ricavare in modo teorico e approssimato la geometria molecolare dei composti utilizzando il modello VSEPR.
In chimica ed in biologia lo studio della forma delle molecole riveste un'enorme importanza per capire e prevedere il loro comportamento ed alcune delle loro proprietà chimiche e fisiche. Si può ricavare in modo teorico e approssimato la geometria molecolare dei composti utilizzando il modello VSEPR.
Il modello VSEPR
In inglese è un acronimo che sta per Valence-Shell Electron-Pair Repulsion e cioè repulsione delle coppie di elettroni del guscio di valenza. In poche parole, il concetto che sta alla base di questo modello è quello di considerare come delle nubi elettroniche sia gli elettroni che costituiscono i legami sia quelli che fanno parte dei cosiddetti doppietti liberi.
Queste "nubi elettroniche", essendo tutte cariche negativamente, tendono a respingersi e ad orientarsi il più distante possibile l'una dall'altra; l'arrangiamento dei doppietti elettronici è tale da massimizzare la loro distanza reciproca.
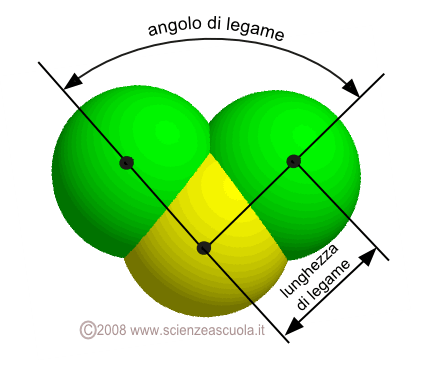
La geometria molecolare deriva dalla combinazione delle distanze tra i nuclei atomici (lunghezza di legame) e degli angoli che si formano tra gli assi dei legami (angolo di legame)
Per disegnare la struttura geometrica di una molecola secondo la teoria VSEPR basta eseguire due semplici operazioni:
I fase) si disegna prima la struttura a puntini (struttura di Lewis: se non lo sapete fare ricercate Lewis su questo sito) e si contano le "nubi elettroniche" che circondano l'atomo centrale; in pratica si sommano i legami e i doppietti liberi. I legami doppi e tripli vengono conteggiati come quelli singoli, dato che non ci interessa il numero degli elettroni quanto piuttosto il numero delle "nubi elettroniche" coinvolte.
II fase) ipotizzare la forma della molecola partendo dall'assunto che le "nubi elettroniche" tenderanno a disporsi il più lontano possibile.
L’applicazione della teoria VSEPR si basa su alcuni presupposti:
- gli atomi formanti la molecola sono legati assieme condividendo doppietti elettronici, chiamati doppietti di legame. Essi possono essere anche più di uno; in questo caso formano legami multipli;
- questi legami multipli (doppi e tripli legami) occupano più spazio di quelli semplici;
- i volumi delle "nubi elettroniche" diminuiscono all'aumentare del valore di elettronegatività degli atomi periferici ed al diminuire del valore di elettronegatività dell'atomo centrale;
- alcuni atomi possono avere doppietti non coinvolti nei legami: in questo caso vengono chiamati doppietti liberi;
- i doppietti di legame e i doppietti liberi, disposti attorno agli atomi, adottano posizioni in cui le loro reciproche interazioni vengono minimizzate (gli elettroni sono caricati negativamente e quindi tendono ad allontanarsi tra di loro il più possibile);
- i doppietti liberi occupano più spazio degli elettroni coinvolti nei legami, cioè "spingono" di più. Questo perché essendo localizzate su un solo atomo, esercitano una forza di repulsione maggiore delle coppie impegnate in un legame.
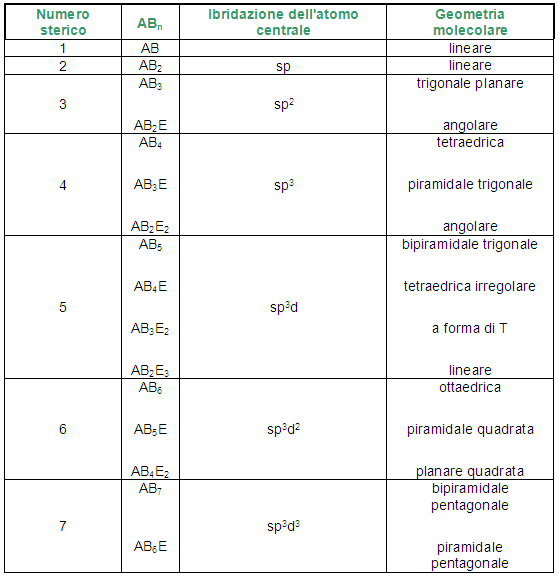
Qui di seguito indicherò la struttura generica di una molecola, determinata in base agli atomi che la costituiscono e al numero sterico. Il numero sterico di una molecola si ottiene dalla somma del numero di atomi legati all’atomo centrale ed il numero di doppietti liberi presenti sull’atomo centrale. Esso è associato anche con il tipo di ibridazione a cui è soggetto l’atomo centrale e viene usato nella teoria del legame di valenza. Ad esempio se il numero sterico dell’atomo centrale è 2 l’atomo centrale è ibridato sp, se è 3 l’atomo centrale è ibridato sp2, se è 4 l’atomo centrale è ibridato sp3, se è 5 l’atomo centrale è ibridato sp3d, se è 6 l’atomo centrale è ibridato sp3d2, se è 7 l’atomo centrale è ibridato sp3d3.
Nella tabella seguente la lettera A rappresenta l’atomo centrale e si sottintende unitario. La B rappresenta il numero di legami (doppietti di legame) che si formano tra l’atomo centrale e quelli periferici. Legami covalenti multipli (doppi, tripli), come già detto, contano come quelli semplici. La E rappresenta il numero di doppietti elettronici liberi presenti sull’atomo centrale. La somma di B ed E è il numero sterico.
Quando il numero sterico è unitario, la molecola è ovviamente diatomica, quindi avrà geometria lineare.
//
Quando il numero sterico è 2, le nubi elettroniche sono dirette dalla parte opposta l'una dall'altra e formano un angolo di 180°.
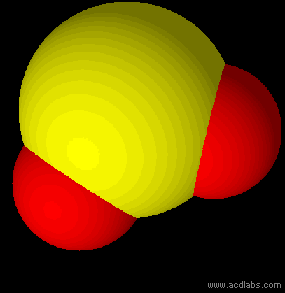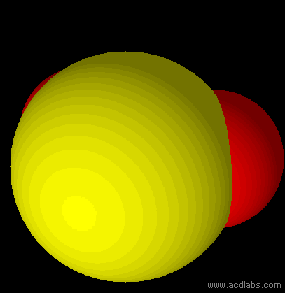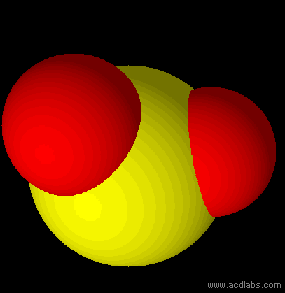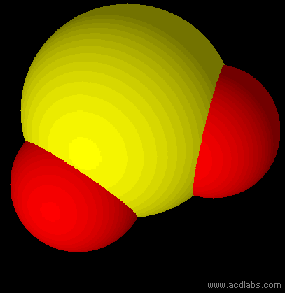
Esempi di molecole di tipo AB2 a geometria lineare: BeCl2, HgCl2, CO2.
![]()
Anidride carbonica: molecola a geometria lineare
Quando il numero sterico è 3, le nubi elettroniche sono dirette ai vertici di un piano trigonale e formano tra di esse un angolo di 120°.
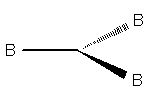
Molecola a geometria trigonale planare (la linea continua indica un legame che corre sullo stesso piano del foglio; la linea spessa indica un legame rivolto verso l'osservatore; quello tratteggiato indica un legame rivolto dalla parte opposta a quella dell'osservatore. L'atomo centrale A non viene disegnato)
Se è presente un doppietto libero, esso darà alla molecola una forma angolare.
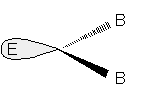
Molecola a geometria angolare
Esempi di molecole di tipo AB3 a geometria trigonale planare: BF3, CO32-, NO3-, SO3.
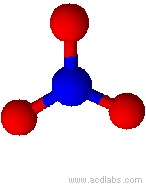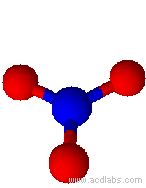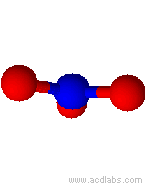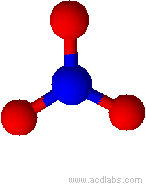
Modello di ione nitrato (angoli di 120˚)
Quando il numero sterico è pari a 4 le nubi elettroniche saranno dirette ai vertici di un tetraedro e formeranno angoli di 109,5°.
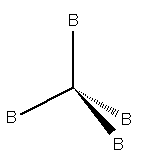
Molecola a geometria tetraedrica
Se è presente un solo doppietto elettronico libero, la molecola avrà la forma di una piramide trigonale:

Molecola a geometria piramidale trigonale, con un doppietto libero
se sono presenti 2 doppietti liberi, avrà una forma angolare.
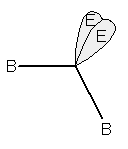
Molecola a geometria angolare, con due doppietti liberi
Esempi di molecole di tipo AB4a geometria tetraedrica: CH4, PO43-, SO42-, ClO4-
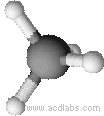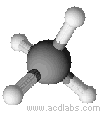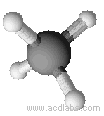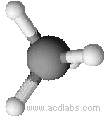
Il metano ha una molecola a geometria tetraedrica (angoli di 109,5˚)
Esempi di molecole di tipo AB3E a geometria piramidale trigonale : NH3, PCl3.
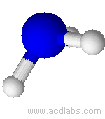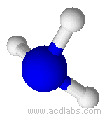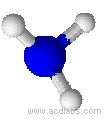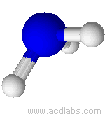
L'ammoniaca ha una molecola a geometria trigonale piramidale (angoli di 107,3˚)
Esempi di molecole di tipo AB2E2, a geometria angolare: H2O, OF2.
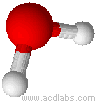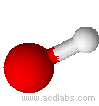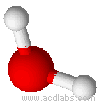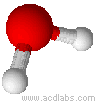
L'acqua ha una molecola a struttura angolare; i due doppietti liberi sull'ossigeno piegano la molecola. L'angolo è di 104,5˚
Quando il numero sterico è pari a 5, le nubi elettroniche saranno dirette verso i vertici di una bipiramide trigonale. La bipiramide trigonale ha due tipi di vertici: tre vertici equatoriali e due vertici apicali. Questi ultimi formano un angolo di 90° rispetto al piano equatoriale ed un angolo di 180° tra di essi. I vertici equatoriali presentano un angolo di 120° l'uno dall'altro.
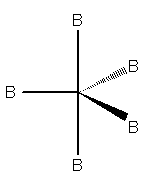
Molecola a geometria bipiramidale trigonale
Esempio: il pentacloruro di fosforo, PCl5.
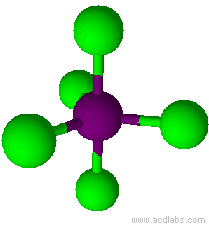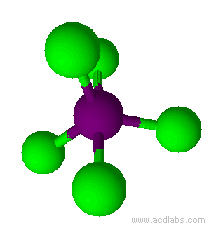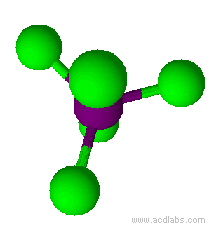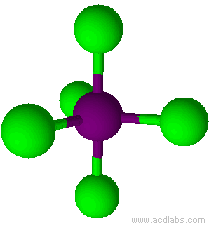
Il pentacloruro di fosforo ha una molecola a geometria bipiramidale trigonale
In presenza di doppietti liberi qui abbiamo ben tre casi: un solo doppietto libero conferirà alla molecola una forma tetraedrica irregolare, come in SF4:
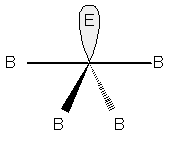
Molecola a geometria tetraedrica irregolare
due doppietti conferiranno alla molecola una forma a T, come in ClF3 o BrF3:
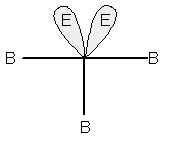
Molecola con geometria a T
tre doppietti conferiranno alla molecola una forma lineare, come in XeF2 oppure I3-.
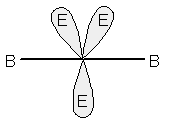
Molecola con geometria lineare
Quando il numero sterico è pari a 6, le nubi elettroniche sono dirette ai vertici di un ottaedro e presentano un angolo di 90° l'una dall'altra.
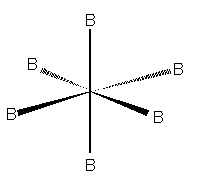
Molecola a geometria ottaedrica
Esempio di molecola di tipo AB6 a geometria ottaedrica: SF6.
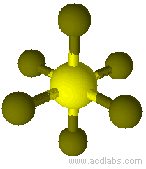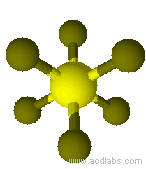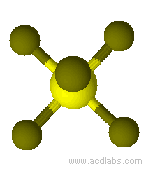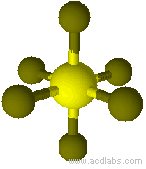
Modello molecolare di esafluoruro di zolfo a geometria ottaedrica
Con un doppietto libero la molecola sarà piramidale quadrata, come in ClF5 e BrF5:
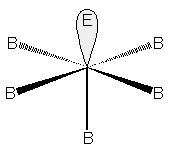
Molecola a geometria piramidale quadrata
con due doppietti liberi planare quadrata, come in XeF4.
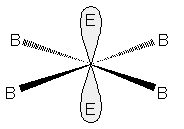
Molecola a geometria quadrata piana
Con un numero sterico pari a 7, le nubi elettroniche saranno dirette verso i vertici di una bipiramide pentagonale, come in IF7:
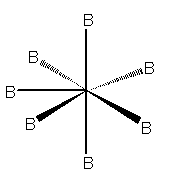
Molecola a geometria bipiramidale pentagonale
con un doppietto libero si formerà una piramide pentagonale, come in XeF6.
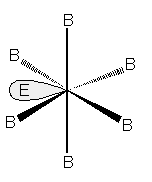
Molecola a geometria piramidale pentagonale
Video
Questo video spiega come disegnare la struttura di una molecola
Bibliografia
Ronald J. Gillespie - Paul L.A. Popelier - Chemical bonding and molecular geometry from Lewis to electron densities - Oxford University Press 2001
F. Bagatti - E. Corradi - A. Desco - C. Ropa - Chimica - Zanichelli 1996 (ISBN 88-08-15936-1)