Le redox e il numero di ossidazione
Le reazioni chimiche possono appartenere a tipologie diverse. Sicuramente, tra quelle più importanti, ci sono le reazioni di ossidoriduzione, dette brevemente redox.
La caratteristica principale delle redox consiste nella variazione del numero di ossidazione degli elementi che partecipano ad esse. Il numero di ossidazione degli elementi legati a formare una molecola corrisponde alla carica che ogni atomo avrebbe se nella molecola gli elettroni di legame fossero assegnati all'elemento più elettronegativo.
Di solito per ossidazione si intende la perdita, da parte di un elemento, di uno o più elettroni, mentre la riduzione viene definita come l'acquisto di uno o più elettroni.
Visto dall'ottica del numero di ossidazione, la riduzione può essere definita come una diminuzione del numero di ossidazione, mentre l'ossidazione può essere definita come un aumento del numero di ossidazione. A questo punto ci può aiutare una rappresentazione grafica:
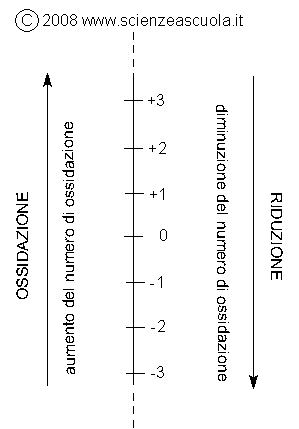
Con questo schema è più facile memorizzare il concetto di ossidazione e di riduzione: associate alla riduzione la diminuzione del numero di ossidazione.
Bisogna sempre, comunque, tener conto degli elettroni messi in gioco; in poche parole deve essere chiaro che, se un elemento si ossida, perde elettroni e aumenta il suo numero di ossidazione, deve essercene un altro che questi elettroni li acquista, riducendosi e diminuendo così il suo numero di ossidazione.
Vediamo un esempio schematico (d'ora in poi, per brevità, indicherò il numero di ossidazione con n.o.):
A → A+ + e- OSSIDAZIONE (A si ossida perché perde un elettrone)
B + e- → B- RIDUZIONE (B si riduce perché acquista un elettrone)
L'elemento che perde l'elettrone (A) e quindi si ossida, si chiama RIDUCENTE, poiché permette la riduzione dell'altro elemento (B).
Viceversa, l'elemento che si riduce (B), si chiama OSSIDANTE, dato che causa l'ossidazione dell'elemento A, il quale perde l'elettrone.
Ricapitolando, le reazioni di ossidoriduzione o redox
A si ossida quindi → perde 1 elettrone quindi → il suo n.o. aumenta quindi → A funge da riducente (nei confronti di B)
B si riduce quindi → acquista 1 elettrone quindi → il suo n.o. diminuisce quindi → B agisce come ossidante (nei confronti di A)
Come si fa a sapere qual è il n.o. di un elemento? É semplice; esistono delle facili regole che ci permettono di ricavarlo.
Vediamole insieme ma, attenzione! Quando il n.o. è positivo, non dovete omettere il segno: indicatelo sempre!
1) il numero di ossidazione di un atomo allo stato elementare è pari a 0 (zero).
Ad esempio:
rame metallico Cu (n.o. = 0)
idrogeno gassoso H2 (n.o. = 0)
2) il numero di ossidazione di uno ione monoatomico equivale alla sua carica:
Ad esempio:
- ione potassio (è monovalente) K+ (n.o. = +1)
- ione bromuro (è monovalente) Br- (n.o. = -1)
Considerate anche la dissociazione dei composti ionici, che in soluzione acquosa danno i rispettivi ioni. Ad esempio KCl: n.o. K = +1 e n.o. Cl = -1, perché dalla dissociazione si ottengono ioni potassio K+ e ioni cloruro Cl-.
3) il n.o. dell'idrogeno, legato a formare composti, è sempre +1, tranne che negli idruri (composti metallici dell'idrogeno) dove vale -1.
4) il n.o. dell'ossigeno in un composto vale -2, tranne che nei perossidi, dove vale -1 oppure quando è legato con il fluoro, dove vale +2.
5) la somma algebrica dei n.o. degli elementi che formano uno ione poliatomico vale quanto la carica dello ione stesso.
6) la somma algebrica dei n.o. degli elementi che formano un composto deve essere 0 (zero).
Facciamo qualche esempio, per esercitarci:
a) Trovare il n.o. dello zolfo nell'anione solfato (ione poliatomico, bivalente, negativo) SO4--
Il n.o. dell'ossigeno è -2, ma gli atomi sono 4, per cui in tutto abbiamo il totale di -8. Nella regola 5 abbiamo detto che la somma algebrica deve corrispondere alla carica dello ione, cioè -2.
Per adesso impostiamo un'equazione (dopo aver capito non ce ne sarà più bisogno):
x-8 = -2
dove x è il n.o. cercato.
Dall'equazione si ricava x = +6, che rappresenta quindi lo stato di ossidazione dello zolfo nell'anione solfato.
b) Trovare il n.o. dell'ossigeno sotto forma di ozono (forma allotropica dell'ossigeno) O3
Abbiamo detto che, quando un atomo è allo stato elementare, il suo n.o. vale zero. Anche se l'ossigeno è legato (molecola poliatomica), lo è comunque con atomi uguali, quindi la differenza di elettronegatività è nulla.
c) Trovare in numero di ossidazione dell'ossigeno nel perossido di idrogeno (acqua ossigenata) H2O2
Si risolve immediatamente ricordando che, in tutti i perossidi, l'ossigeno ha un n.o. uguale a -1.
Oppure si può disegnare la struttura della molecola (va bene anche senza tener conto degli atomi di legame; in questo caso ci interessa il n.o.) così:
H-O-O-H
da cui si vede che, essendo il n.o. di ciascun idrogeno pari a +1 la loro somma vale +2. Siccome la somma algebrica dei n.o. deve valere zero, vuol dire che la somma dei n.o. dei due atomi di ossigeno deve essere per forza pari a -2, quindi -1 per ciascun atomo.
d) Trovare il n.o. dell'alluminio nel triossido di dialluminio (allumina) Al2O3
L'ossigeno vale -2. Gli atomi sono tre, per cui il n.o. totale vale -6. Secondo la regola 6), la carica totale dell'alluminio vale +6, ma essendo 2 gli atomi, il n.o. di ciascun atomo di alluminio vale +3.
e) Trovare il n.o. dell'alluminio nel composto idruro di litio e alluminio.
Essendo un idruro, sappiamo che il n.o. dell'idrogeno vale -1, essendo 4 gli atomi di idrogeno, il n.o. totale vale -4. La somma dei n.o. del litio e dell'alluminio deve valere +4. Si può ricavare il n.o. del litio considerando che, essendo un metallo del I gruppo A della tavola periodica, tende a perdere facilmente il suo elettrone di valenza, formando quindi uno ione monovalente positivo (ricade quindi nella regola 2). Quindi possiamo assegnare al litio n.o. = +1; quindi il n.o. dell'alluminio vale +3.
Riassumendo avremo
n.o. Li = +1
n.o. Al = +3
n.o. H = -1
